हमारे समय में भौतिकी एक बहुत ही सामान्य विज्ञान बन गया है। यह वस्तुतः हर जगह मौजूद है। सबसे प्रारंभिक उदाहरण: आपके यार्ड में एक सेब का पेड़ उगता है, और उस पर फल पकते हैं, समय आता है और सेब गिरने लगते हैं, लेकिन वे किस दिशा में गिरते हैं? सार्वभौमिक गुरुत्वाकर्षण के नियम के लिए धन्यवाद, हमारा भ्रूण जमीन पर गिरता है, यानी नीचे जाता है, लेकिन ऊपर नहीं। यह भौतिकी के सबसे प्रसिद्ध उदाहरणों में से एक था, लेकिन आइए थर्मोडायनामिक्स पर ध्यान दें, या अधिक सटीक रूप से, चरण संतुलन पर ध्यान दें, जो हमारे जीवन में कम महत्वपूर्ण नहीं हैं।
ऊष्मागतिकी

सबसे पहले इस टर्म पर नजर डालते हैं। ΘερΜοδυναΜική - ग्रीक में यह शब्द कैसा दिखता है। पहला भाग o का अर्थ है "गर्मी", और दूसरा δυναΜική का अर्थ है "ताकत"। थर्मोडायनामिक्स भौतिकी की एक शाखा है जो मैक्रोस्कोपिक सिस्टम के गुणों के साथ-साथ ऊर्जा को परिवर्तित करने और स्थानांतरित करने के विभिन्न तरीकों का अध्ययन करती है। इस खंड में, विभिन्न अवस्थाओं और प्रक्रियाओं का विशेष रूप से अध्ययन किया जाता है ताकि तापमान की अवधारणा को विवरण में पेश किया जा सके (यह एक भौतिक मात्रा है जो एक थर्मोडायनामिक प्रणाली की विशेषता है और इसका उपयोग करके मापा जाता हैकुछ उपकरण)। थर्मोडायनामिक सिस्टम में चल रही सभी प्रक्रियाओं को केवल सूक्ष्म मात्रा (दबाव और तापमान, साथ ही घटकों की एकाग्रता) द्वारा वर्णित किया जाता है।
क्लैपेरॉन-क्लॉसियस समीकरण
हर भौतिक विज्ञानी इस समीकरण को जानता है, लेकिन आइए इसे टुकड़े-टुकड़े कर दें। यह कुछ पदार्थों के एक चरण से दूसरे चरण में संक्रमण की संतुलन प्रक्रियाओं को संदर्भित करता है। यह ऐसे उदाहरणों में स्पष्ट रूप से देखा जाता है: पिघलने, वाष्पीकरण, उच्च बनाने की क्रिया (उत्पादों को संरक्षित करने के तरीकों में से एक, जो नमी को पूरी तरह से हटाकर होता है)। सूत्र स्पष्ट रूप से चल रही प्रक्रियाओं को दिखाता है:
- n=पीवी/आरटी;
- जहां T पदार्थ का तापमान है;
- पी-प्रेशर;
- चरण संक्रमण की आर-विशिष्ट गर्मी;
- V- विशिष्ट मात्रा में परिवर्तन।
समीकरण के निर्माण का इतिहास

क्लौसियस-क्लैपेरॉन समीकरण ऊष्मागतिकी के दूसरे नियम की एक उत्कृष्ट गणितीय व्याख्या है। इसे "क्लॉसियस असमानता" के रूप में भी जाना जाता है। स्वाभाविक रूप से, प्रमेय को स्वयं वैज्ञानिक द्वारा विकसित किया गया था, जो सिस्टम में गर्मी के प्रवाह और एन्ट्रापी के साथ-साथ इसके पर्यावरण के बीच संबंध की व्याख्या करना चाहता था। यह समीकरण क्लॉसियस द्वारा एन्ट्रापी को समझाने और परिमाणित करने के अपने प्रयासों में विकसित किया गया था। शाब्दिक अर्थ में, प्रमेय हमें यह निर्धारित करने का अवसर देता है कि चक्रीय प्रक्रिया उत्क्रमणीय है या अपरिवर्तनीय है। यह असमानता हमें दूसरे नियम को समझने के लिए एक मात्रात्मक सूत्र प्रदान करती है।
एंट्रॉपी के विचार पर काम करने वाले पहले वैज्ञानिकों में से एक थे, और उन्होंने इसे दिया भीप्रक्रिया का नाम। जिसे अब क्लॉजियस के प्रमेय के रूप में जाना जाता है, वह पहली बार 1862 में रुडोल्फ के छठे काम, ऑन द यूज ऑफ ट्रांसफॉर्मेशन इक्विवेलेंस थ्योरम फॉर इंटीरियर वर्क में प्रकाशित हुआ था। वैज्ञानिक ने सिस्टम में हीटिंग (δ Q) द्वारा एन्ट्रॉपी और ऊर्जा प्रवाह के बीच आनुपातिक संबंध दिखाने की कोशिश की। निर्माण में, इस थर्मल ऊर्जा को काम में परिवर्तित किया जा सकता है, और इसे चक्रीय प्रक्रिया के माध्यम से गर्मी में परिवर्तित किया जा सकता है। रूडोल्फ ने साबित किया कि "चक्रीय प्रक्रिया में होने वाले सभी परिवर्तनों का बीजगणितीय योग केवल शून्य से कम या चरम मामलों में, शून्य के बराबर हो सकता है।"
बंद पृथक प्रणाली
आइसोलेटेड सिस्टम निम्न में से एक है:
- भौतिक तंत्र दूसरों से दूर है जो उनके साथ बातचीत नहीं करते हैं।
- ऊष्मप्रवैगिकी प्रणाली कठोर अचल दीवारों से बंद है जिसके माध्यम से न तो पदार्थ और न ही ऊर्जा गुजर सकती है।
इस तथ्य के बावजूद कि विषय आंतरिक रूप से अपने स्वयं के गुरुत्वाकर्षण से संबंधित है, एक पृथक प्रणाली को आमतौर पर बाहरी गुरुत्वाकर्षण और अन्य दूर के बलों की सीमा से परे ले जाया जाता है।
इसकी तुलना (ऊष्मप्रवैगिकी में उपयोग की जाने वाली अधिक सामान्य शब्दावली में) चयनात्मक दीवारों से घिरी एक बंद प्रणाली कहलाती है, जिसके माध्यम से ऊर्जा को गर्मी या काम के रूप में स्थानांतरित किया जा सकता है, लेकिन कोई फर्क नहीं पड़ता। और एक खुली प्रणाली के साथ जिसमें पदार्थ और ऊर्जा प्रवेश करती है या बाहर निकलती है, हालांकि इसमें विभिन्न अभेद्य दीवारें हो सकती हैंइसकी सीमाओं के हिस्से।
एक पृथक प्रणाली संरक्षण कानून का पालन करती है। ऊष्मप्रवैगिकी में अक्सर पदार्थ और ऊर्जा को अलग-अलग अवधारणा माना जाता है।
ऊष्मप्रवैगिकी संक्रमण
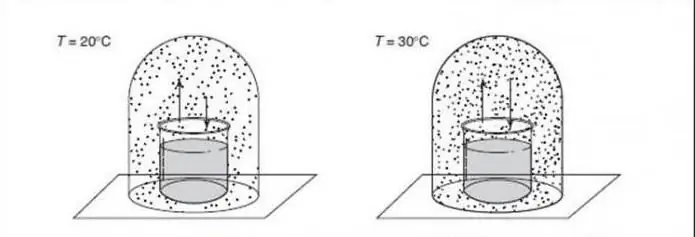
क्वांटम चरण संक्रमणों को समझने के लिए, उनकी तुलना शास्त्रीय परिवर्तनों (जिसे थर्मल व्युत्क्रम भी कहा जाता है) के साथ करना उपयोगी है। सीपीटी एक प्रणाली के थर्मोडायनामिक गुणों में पुच्छ का वर्णन करता है। यह कणों के पुनर्गठन का संकेत देता है। एक विशिष्ट उदाहरण पानी का हिमीकरण संक्रमण है, जो एक तरल और एक ठोस के बीच एक सहज संक्रमण का वर्णन करता है। शास्त्रीय चरण वृद्धि प्रणाली की ऊर्जा और इसके थर्मल उतार-चढ़ाव की एन्ट्रापी के बीच प्रतिस्पर्धा के कारण होती है।
एक शास्त्रीय प्रणाली में शून्य तापमान पर कोई एन्ट्रापी नहीं होती है और इसलिए कोई चरण परिवर्तन नहीं हो सकता है। उनका क्रम पहले असंतत व्युत्पन्न थर्मोडायनामिक क्षमता द्वारा निर्धारित किया जाता है। और, ज़ाहिर है, इसका पहला आदेश है। फेरोमैग्नेट से पैरामैग्नेट में चरण परिवर्तन निरंतर और दूसरे क्रम के होते हैं। एक आदेशित से एक अव्यवस्थित चरण में होने वाले इन निरंतर परिवर्तनों को एक क्रम पैरामीटर द्वारा वर्णित किया जाता है जो शून्य है। उपरोक्त फेरोमैग्नेटिक ट्रांसफॉर्मेशन के लिए, ऑर्डर पैरामीटर सिस्टम का कुल मैग्नेटाइजेशन होगा।
गिब्स संभावित
गिब्स फ्री एनर्जी बिना विस्तार के काम की अधिकतम मात्रा है जिसे थर्मोडायनामिक बंद सिस्टम से हटाया जा सकता है (जो गर्मी का आदान-प्रदान कर सकता है और पर्यावरण के साथ काम कर सकता है)। ऐसाअधिकतम परिणाम केवल पूरी तरह से प्रतिवर्ती प्रक्रिया में ही प्राप्त किया जा सकता है। जब सिस्टम पहली अवस्था से दूसरी अवस्था में वापस बदलता है, तो गिब्स मुक्त ऊर्जा में कमी उसके वातावरण में सिस्टम द्वारा किए गए प्रदर्शन के बराबर होती है, दबाव बलों के कार्य को घटाकर।
संतुलन की स्थिति

ऊष्मप्रवैगिकी और यांत्रिक संतुलन ऊष्मागतिकी की एक स्वयंसिद्ध अवधारणा है। यह एक या अधिक प्रणालियों की आंतरिक स्थिति है जो कम या ज्यादा पारगम्य या अभेद्य दीवारों से जुड़ी होती हैं। इस अवस्था में, किसी प्रणाली के भीतर या प्रणालियों के बीच, पदार्थ या ऊर्जा का कोई शुद्ध मैक्रोस्कोपिक प्रवाह नहीं होता है।
आंतरिक संतुलन की स्थिति की अपनी अवधारणा में, मैक्रोस्कोपिक परिवर्तन नहीं होता है। सिस्टम एक साथ पारस्परिक थर्मल, मैकेनिकल, रासायनिक (स्थिर), विकिरण संतुलन में हैं। वे एक ही रूप में हो सकते हैं। इस प्रक्रिया में, सभी दृश्य एक साथ और अनिश्चित काल तक सहेजे जाते हैं जब तक कि भौतिक संचालन टूट न जाए। मैक्रोस्कोपिक संतुलन में, पूरी तरह से सटीक संतुलित आदान-प्रदान होता है। उपरोक्त प्रमाण इस अवधारणा की भौतिक व्याख्या है।
मूल बातें
प्रत्येक नियम, प्रमेय, सूत्र की अपनी नींव होती है। आइए चरण संतुलन के नियम के 3 आधारों को देखें।
- चरण पदार्थ का एक रूप है, रासायनिक संरचना, भौतिक अवस्था और यांत्रिक संतुलन में सजातीय। विशिष्ट चरण ठोस, तरल और गैसीय होते हैं।एक अलग सीमा से अलग किए गए दो अमिश्रणीय तरल पदार्थ (या विभिन्न रचनाओं के साथ तरल मिश्रण) को दो अलग-अलग चरण और अमिश्रणीय ठोस माना जाता है।
- घटकों की संख्या (सी) प्रणाली के रासायनिक रूप से स्वतंत्र घटकों की संख्या है। सिस्टम के सभी चरणों की संरचना को निर्धारित करने के लिए आवश्यक स्वतंत्र प्रजातियों की न्यूनतम संख्या।
- इस संदर्भ में स्वतंत्रता की डिग्री (एफ) की संख्या गहन चर की संख्या है जो एक दूसरे से स्वतंत्र हैं।
चरण संतुलन द्वारा वर्गीकरण
- निरंतर शुद्ध स्थानांतरण की प्रतिक्रियाएं (जिसे अक्सर ठोस अवस्था प्रतिक्रियाएं कहा जाता है) विभिन्न संरचना के ठोस पदार्थ के बीच होती हैं। उनमें तरल पदार्थ (एच, सी) में पाए जाने वाले तत्व शामिल हो सकते हैं, लेकिन इन तत्वों को ठोस चरणों में रखा जाता है, इसलिए कोई भी तरल चरण अभिकारक या उत्पाद के रूप में शामिल नहीं होते हैं (एच 2ओ, सीओ 2). ठोस शुद्ध स्थानांतरण प्रतिक्रियाएं निरंतर या असंतत, या टर्मिनल हो सकती हैं।
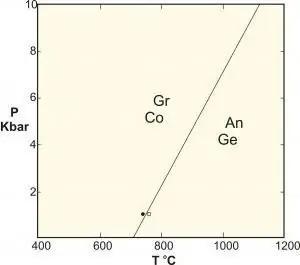
- पॉलीमॉर्फिक एक विशेष प्रकार की ठोस चरण प्रतिक्रिया होती है जिसमें समान संरचना के चरण शामिल होते हैं। शास्त्रीय उदाहरण एल्यूमीनियम सिलिकेट्स केनाइट-सिलिमेनाइट-एंडलुसाइट के बीच की प्रतिक्रियाएं हैं, उच्च दबाव पर ग्रेफाइट का हीरे में रूपांतरण, और कैल्शियम कार्बोनेट का संतुलन।
संतुलन के नियम

द गिब्स फैक्ट्री रूल का प्रस्ताव योशिय्याह विलार्ड गिब्स ने अपने प्रसिद्ध पेपर "द इक्विलिब्रियम ऑफ हेटरोजेनियस सब्सटेंस" में दिया था, जो 1875 से 1878 तक प्रकाशित हुआ था। यह लागू होता हैथर्मोडायनामिक संतुलन में गैर-प्रतिक्रियाशील बहुघटक विषम प्रणाली और एक दी गई समानता है:
- एफ=सी-पी+2;
- जहां एफ स्वतंत्रता की डिग्री की संख्या है;
- सी - घटकों की संख्या;
- P - एक दूसरे के साथ थर्मोडायनामिक संतुलन में चरणों की संख्या।
स्वतंत्रता की डिग्री की संख्या निर्वासित गहन चर की संख्या है। थर्मोडायनामिक मापदंडों की सबसे बड़ी संख्या, जैसे तापमान या दबाव, जो एक दूसरे को प्रभावित किए बिना एक साथ और मनमाने ढंग से भिन्न हो सकते हैं। एक-घटक प्रणाली का एक उदाहरण एक शुद्ध रसायन वाला एक है, जबकि दो-घटक प्रणालियों, जैसे पानी और इथेनॉल के मिश्रण में दो स्वतंत्र घटक होते हैं। विशिष्ट चरण संक्रमण (चरण संतुलन) ठोस, तरल पदार्थ, गैस हैं।
लगातार दबाव में चरण नियम
विभिन्न ठोस संरचनाओं के बीच चरण परिवर्तन से निपटने वाले सामग्री विज्ञान में अनुप्रयोगों के लिए, एक निरंतर दबाव अक्सर होता है (उदाहरण के लिए एक वातावरण) और इसे स्वतंत्रता की डिग्री के रूप में अनदेखा किया जाता है, इसलिए नियम बन जाता है: एफ=सी - पी + 1.
यह सूत्र कभी-कभी "संघनित चरण नियम" नाम से पेश किया जाता है, लेकिन जैसा कि हम जानते हैं, यह इन प्रणालियों पर लागू नहीं होता है जो उच्च दबावों (उदाहरण के लिए, भूविज्ञान में) के अधीन होते हैं, क्योंकि इनके परिणाम दबाव विनाशकारी परिणाम पैदा कर सकता है।
ऐसा लग सकता है कि चरण संतुलन सिर्फ एक खाली वाक्यांश है, और कुछ भौतिक प्रक्रियाएं हैं जिनमें यह क्षणशामिल है, लेकिन, जैसा कि हमने देखा है, इसके बिना, हम जानते हैं कि कई कानून काम नहीं करते हैं, इसलिए आपको इन अद्वितीय, रंगीन, हालांकि थोड़ा उबाऊ नियमों से थोड़ा परिचित होने की आवश्यकता है। इस ज्ञान ने कई लोगों की मदद की है। उन्होंने सीखा कि उन्हें खुद पर कैसे लागू किया जाए, उदाहरण के लिए, इलेक्ट्रीशियन, चरणों के साथ काम करने के नियमों को जानकर, खुद को अनावश्यक खतरे से बचा सकते हैं।






