गैसों में दो राज्यों के बीच रुद्धोष्म संक्रमण एक आइसोप्रोसेस नहीं है, हालांकि, यह न केवल विभिन्न तकनीकी प्रक्रियाओं में, बल्कि प्रकृति में भी महत्वपूर्ण भूमिका निभाता है। इस लेख में, हम विचार करेंगे कि यह प्रक्रिया क्या है, और एक आदर्श गैस के लिए रुद्धोष्म समीकरण भी देंगे।
आदर्श गैस संक्षेप में
आदर्श गैस वह होती है जिसमें उसके कणों के बीच कोई अंतःक्रिया नहीं होती और उनका आकार शून्य के बराबर होता है। प्रकृति में, निश्चित रूप से, एक सौ प्रतिशत आदर्श गैसें नहीं होती हैं, क्योंकि वे सभी अणुओं और आकार के परमाणुओं से बनी होती हैं, जो हमेशा कम से कम वैन डेर वाल्स बलों की मदद से एक दूसरे के साथ बातचीत करती हैं। फिर भी, कई वास्तविक गैसों के लिए व्यावहारिक समस्याओं को हल करने के लिए वर्णित मॉडल को अक्सर पर्याप्त सटीकता के साथ किया जाता है।
एक आदर्श गैस का मुख्य समीकरण क्लैपेरॉन-मेंडेलीव नियम है। यह निम्नलिखित रूप में लिखा गया है:
पीवी=एनआरटी.
यह समीकरण उत्पाद के बीच एक सीधा आनुपातिकता स्थापित करता हैआयतन V पर दबाव P और निरपेक्ष तापमान T पर पदार्थ n की मात्रा। R का मान गैस स्थिरांक है, जो आनुपातिकता कारक की भूमिका निभाता है।
रुद्धोष्म प्रक्रिया क्या है?
एक रुद्धोष्म प्रक्रिया एक गैस प्रणाली की अवस्थाओं के बीच एक संक्रमण है जिसमें पर्यावरण के साथ ऊर्जा का आदान-प्रदान नहीं होता है। इस मामले में, सिस्टम की सभी तीन थर्मोडायनामिक विशेषताओं (पी, वी, टी) में परिवर्तन होता है, और पदार्थ की मात्रा स्थिर रहती है।
रुद्धोष्म प्रसार और संकुचन में अंतर स्पष्ट कीजिए। दोनों प्रक्रियाएं सिस्टम की आंतरिक ऊर्जा के कारण ही होती हैं। इसलिए, विस्तार के परिणामस्वरूप, सिस्टम का दबाव और विशेष रूप से तापमान नाटकीय रूप से गिर जाता है। इसके विपरीत, रुद्धोष्म संपीड़न से तापमान और दबाव में सकारात्मक उछाल आता है।
पर्यावरण और सिस्टम के बीच गर्मी के आदान-प्रदान को रोकने के लिए, उत्तरार्द्ध में थर्मली इंसुलेटेड दीवारें होनी चाहिए। इसके अलावा, प्रक्रिया के समय को छोटा करने से सिस्टम में और उससे गर्मी का प्रवाह काफी कम हो जाता है।
रुद्धोष्म प्रक्रिया के लिए पॉइसन समीकरण

ऊष्मप्रवैगिकी का पहला नियम इस प्रकार लिखा गया है:
क्यू=Δयू + ए.
दूसरे शब्दों में, सिस्टम को संचारित ऊष्मा Q का उपयोग सिस्टम द्वारा कार्य A करने और उसकी आंतरिक ऊर्जा ΔU को बढ़ाने के लिए किया जाता है। रुद्धोष्म समीकरण लिखने के लिए, Q=0 रखना चाहिए, जो अध्ययन के तहत प्रक्रिया की परिभाषा के अनुरूप है। हमें मिलता है:
Δयू=-ए.
आइसोकोरिक के साथएक आदर्श गैस में प्रक्रिया, सारी गर्मी आंतरिक ऊर्जा को बढ़ाने के लिए जाती है। यह तथ्य हमें समानता लिखने की अनुमति देता है:
Δयू=सीवीΔटी.
जहाँ CV समस्थानिक ताप क्षमता है। कार्य ए, बदले में, निम्नानुसार गणना की जाती है:
ए=पीडीवी।
जहां dV एक छोटा वॉल्यूम परिवर्तन है।
क्लैपेरॉन-मेंडेलीव समीकरण के अतिरिक्त, निम्नलिखित समीकरण एक आदर्श गैस के लिए मान्य है:
सीपी- सीवी=आर.
जहां CP समदाब रेखीय ताप क्षमता है, जो समद्विबाहु ताप क्षमता से हमेशा अधिक होती है, क्योंकि यह विस्तार के कारण गैस के नुकसान को ध्यान में रखती है।
उपरोक्त समीकरणों का विश्लेषण और तापमान और आयतन को एकीकृत करते हुए, हम निम्नलिखित रुद्धोष्म समीकरण पर पहुंचते हैं:
टीवीγ-1=कास्ट.
यहाँ रुद्धोष्म सूचकांक है। यह समदाब रेखीय ताप क्षमता और समद्विबाहु के अनुपात के बराबर है। इस समानता को रुद्धोष्म प्रक्रिया के लिए पॉइसन समीकरण कहा जाता है। क्लैपेरॉन-मेंडेलीव कानून को लागू करते हुए, आप दो और समान अभिव्यक्तियां लिख सकते हैं, केवल पैरामीटर पी-टी और पी-वी के माध्यम से:
टीपीγ/(γ-1)=कास्ट;
पीवीγ=कास्ट.
विभिन्न अक्षों में रुद्धोष्म ग्राफ दिया जा सकता है। नीचे इसे P-V अक्षों में दिखाया गया है।
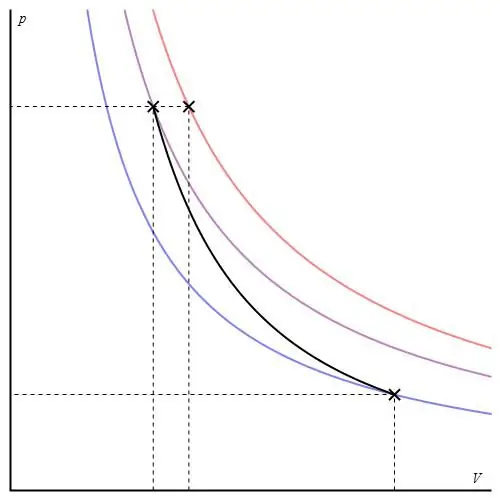
ग्राफ पर रंगीन रेखाएं समताप रेखा के अनुरूप होती हैं, काला वक्र रूद्धोष्म होता है। जैसा कि देखा जा सकता है, एडियाबैट किसी भी समताप मंडल की तुलना में अधिक तीक्ष्ण व्यवहार करता है। इस तथ्य की व्याख्या करना आसान है: समतापी के लिए, दबाव वापस बदल जाता हैआयतन के समानुपाती, लेकिन आइसोबाथ के लिए, दबाव तेजी से बदलता है, क्योंकि किसी भी गैस प्रणाली के लिए घातांक γ>1 है।
उदाहरण समस्या
प्रकृति में, पर्वतीय क्षेत्रों में, जब वायु द्रव्यमान ढलान से ऊपर जाता है, तो इसका दबाव कम हो जाता है, यह मात्रा में बढ़ जाता है और ठंडा हो जाता है। यह रुद्धोष्म प्रक्रिया ओस बिंदु को कम करती है और तरल और ठोस वर्षा पैदा करती है।

निम्नलिखित समस्या को हल करने का प्रस्ताव है: पहाड़ की ढलान के साथ वायु द्रव्यमान को उठाने की प्रक्रिया में, पैर पर दबाव की तुलना में दबाव 30% कम हो जाता है। यदि पैर पर यह 25 oC?
था तो इसका तापमान बराबर क्या था?
समस्या को हल करने के लिए, निम्न रुद्धोष्म समीकरण का उपयोग करें:
टीपीγ/(γ-1)=const.
इसे इस रूप में लिखना बेहतर है:
टी2/टी1=(पी2/पी 1)(γ-1)/γ.
यदि P1 को 1 वायुमंडल के रूप में लिया जाए, तो P2 0.7 वायुमंडल के बराबर होगा। वायु के लिए रुद्धोष्म सूचकांक 1.4 है, क्योंकि इसे द्विपरमाणुक आदर्श गैस माना जा सकता है। T1 का तापमान मान 298.15 K है। इन सभी संख्याओं को उपरोक्त व्यंजक में प्रतिस्थापित करने पर, हमें T2=269.26 K प्राप्त होता है, जो कि - 3, 9 ओसी.






